通用RNA提取試劑盒(離心柱型)(R1051)
通用RNA提取試劑盒
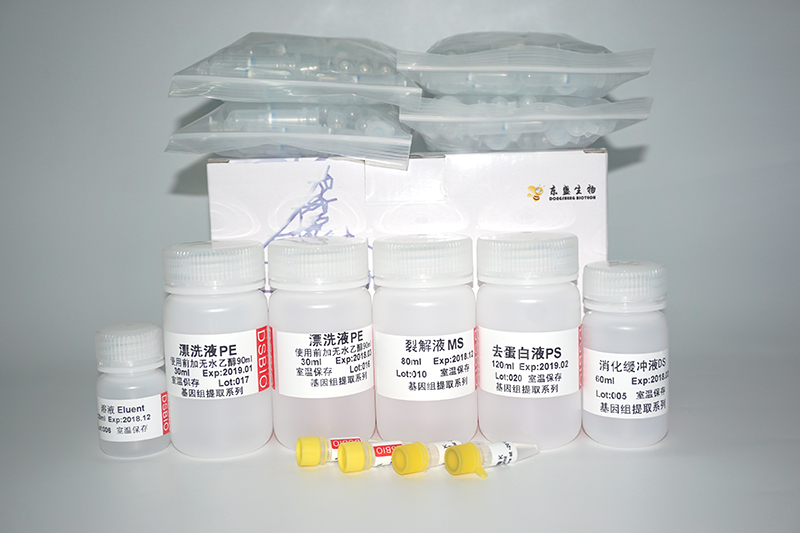
產品組分
貨號 | R1051(50 次) |
溶液 RL | 60 ml |
溶液 RPI | 18 ml |
溶液 RW | 12 ml |
DEPC處理水 | 10 ml |
RNase-free 純化柱 | 50 個 |
RNase-free 離心管 | 50 個 |
說明書 | 1 份 |
需要自備的溶液
● 氯仿
● 無水乙醇
產品說明
通用RNA提取試劑盒是經過改進開發(fā)的新一代產品,提高了裂解液的裂解能力和提取的靈敏度,通過在特定適宜的條件下特異、可逆地結合RNA,而各種蛋白質和其他雜質均可被去除掉,同時改進的硅基質膜增強了對RNA的吸附能力,得到的RNA純度更好,質量更高。該試劑盒可從各種細胞或組織中快速提取總RNA,每個吸附柱每次可處理50–100 mg 組織或5×106 細胞,可同時處理大量不同樣品,一個小時內即可完成反應。提取的總RNA沒有DNA和蛋白的污染,可用于Northern blot、Dot blot、polyA 篩選、體外翻譯、RNase保護分析和分子克隆等。
保存條件
溶液RL應在2-8℃避光保存,其他溶液和純化柱室溫保存。
注意事項---------------------------------------------------------------------------------------------------------
● 初次使用溶液RPI和溶液RW前,需按比例加入無水乙醇。18 ml溶液RPI中加入12 ml無水乙醇(3:2),12 ml溶液RW中加入48 ml無水乙醇(1:4)。
● 嚴防操作環(huán)境、使用的容器、耗材和試劑的RNase污染。操作過程中勤換手套。
● 使用本產品提取的RNA一般不含有DNA污染。在極少數情況下(與組織pH值等相關),如果有DNA污染而又必須去除,則可以用RNase-free的DNase處理樣品。
● 請嚴格遵照操作步驟操作。
● 不同起始材料的用量及溶液RL的用量不同(參見下表),過多或過少的使用量都可能影響RNA的質量或產量。若起始材料量很少,RNA預計產量很低,在異丙醇沉淀時,可加入20mg/ml的肝糖原溶液0.5-1 μl促進RNA沉淀。
樣品用量 | 溶液RL的用量 |
10cm2的貼壁培養(yǎng)細胞 | 1 ml |
107的懸浮培養(yǎng)細胞 | 1-2 ml |
100 μl的白細胞 | 2 ml |
50-100 mg的普通組織樣品 | 1 ml |
50-100 mg的特殊組織樣品(肝、脾、骨及軟骨等) | 2 ml |
15-30 mg的植物材料(多糖和多酚含量不高的) | 1 ml |
● 有關RNA的吸光度說明如下:
260nm、320nm、230nm、280nm下的吸光度分別代表核酸、背景(溶液渾濁度)、鹽濃度和蛋白質等有機物的污染程度,質量較好的RNA的R值應在1.8-2.0之間,當R<1.8時,溶液中的蛋白質等有機物的污染比較明顯;當>2.2時,說明RNA已經被水解成單核苷酸。
● RNA濃度=(OD260-OD320)*稀釋倍數*0.04 μg/μl。
操作步驟---------------------------------------------------------------------------------------------------------
第一次使用前應在溶液 RPI、溶液 RW中加入無水乙醇,加入量請參見瓶上標簽。
1. 樣品處理
● 組織:將組織在液氮中磨碎。每50–100 mg組織加1 ml溶液RL,用勻漿儀進行勻漿處理。樣品體積不應超過溶液RL體積的十分之一。
● 單層培養(yǎng)細胞:直接在培養(yǎng)板中加入溶液RL裂解細胞,每10 cm2 面積加1 ml溶液RL。用取樣器抽打幾次。
● 溶液RL的加入量根據培養(yǎng)瓶面積決定,不是由細胞數決定。如果加量不足,可能導致提取的RNA中有DNA污染。
c. 細胞懸液:離心取細胞,棄上清。每5–10×106動物細胞和植物細胞加入1 ml溶液RL。加溶液RL前不要洗滌細胞,以免降解mRNA。
2. 將勻漿樣品在15–30℃放置5 min,使得核酸蛋白復合物完全分離。
3. 可選步驟:4℃ 12,000 rpm (~13,400×g) 離心5分鐘,取上清,轉入一個新的無RNase的離心管中。
● 如果樣品中含有較多蛋白、脂肪、多糖或肌肉、植物結節(jié)部分等,可加此步驟離心去除。離心得到的沉淀中包括細胞外膜、多糖、高分子量DNA,RNA存在于上清溶液中。
(如樣品含有較多多糖多酚,請增加以下步驟,在上清液中加入0.2×上清液體積的5 M NaCl及1×上清液體積的酚/氯仿(1:1),混勻,12000 rpm 離心5-10 min ,取上清液加入等體積氯仿,混勻,12000 rpm 離心5-10 min,至第4步。)
4. 加入200 μl氯仿,蓋好管蓋,劇烈振蕩15 s,室溫放置3 min。
5. 4℃ 12,000 rpm離心10 min,樣品會分成三層,從上至下依次是:無色的水相,白色的中間層和黃色的有機相,RNA主要存在于水相中,水相的體積約為所用溶液RL試劑的60%。把水相轉移到新管中,進行下一步操作。注意不要吸到中間層。
● 第一次使用前應在溶液 RPI、溶液RW中加入無水乙醇,加入量請參見瓶上標簽。
6. 緩慢加入0.5 倍體積無水乙醇,混勻(此時可能會出現沉淀)。將得到溶液和沉淀一起轉入純化柱中,4℃ 12,000 rpm離心30 s。4℃ 12,000 rpm離心30 s,棄掉收集管中的廢液。
● 若溶液體積大于純化柱容積(700 μl),可分兩次離心。
7. 向純化柱中加入500 μl溶液RPI(使用前請先檢查是否已加入乙醇),4℃ 12,000 rpm離心30 s,棄廢液。
8. 向純化柱中加入500 μl溶液RW(使用前請先檢查是否已加入乙醇),室溫靜置2 min, 4℃ 12,000 rpm離心30 s,棄廢液。
9. 向純化柱中加入500 μl溶液RW,室溫靜置2分鐘,4℃ 12,000 rpm離心30 s,去除殘余液體。
10. 將純化柱放入2ml收集管中,4℃ 12,000 rpm離心2 min,去除殘余液體。
● 此步驟的目的是將純化柱中殘余的漂洗液去除,離心后將純化柱在室溫放置片刻,或置于超凈工作臺上通風片刻,以充分晾干。如果有漂洗液殘留,可能會影響后續(xù)的RT等實驗操作。
11. 將純化柱轉入一個新的離心管中,加30–100 μl RNase-free ddH2O,室溫放置2 min,4℃ 12,000 rpm離心2 min。
● 洗脫緩沖液體積不應少于30 μl,體積過小影響回收效率。且RNA應保存在-70℃(-80℃),以防降解。
● 如果想提高RNA得率,可重復上步操作一次,合并兩次得到的溶液。





 電話:020-87791356(國內業(yè)務) 020-31600213(海外業(yè)務)
電話:020-87791356(國內業(yè)務) 020-31600213(海外業(yè)務) 銷售郵箱:sales@gdsbio.com
銷售郵箱:sales@gdsbio.com  技術支持:technique@gdsbio.com
技術支持:technique@gdsbio.com